Radiactividad
La radiactividad o radioactividad es un fenómeno físico por el cual los núcleos de algunos elementos químicos, llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas radiográficas, ionizar gases, producir fluorescencia, atravesar cuerpos opacos a la luz ordinaria, entre otros. Debido a esa capacidad, se les suele denominar radiaciones ionizantes (en contraste con las no ionizantes). Las radiaciones emitidas pueden ser electromagnéticas, en forma de rayos X o rayos gamma, o bien corpusculares, como pueden ser núcleos de helio, electrones o positrones, protones u otras. En resumen, es un fenómeno que ocurre en los núcleos de ciertos elementos, inestables, que son capaces de transformarse, o decaer, espontáneamente, en núcleos atómicos de otros elementos más estables.
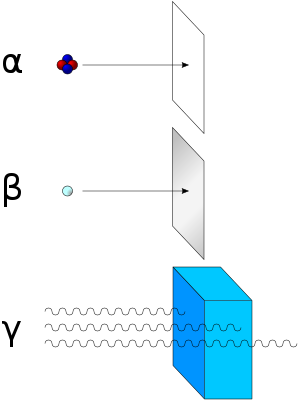
La radiactividad ioniza el medio que atraviesa. Una excepción la constituye el neutrón, que posee carga neutra (igual carga positiva como negativa), pero ioniza lamateria en forma indirecta. En las desintegraciones radiactivas se tienen varios tipos de radiación: alfa, beta, gamma y neutrones libres.
La radiactividad es una propiedad de los isótopos que son "inestables", es decir, que se mantienen en un estado excitado en sus capas electrónicas o nucleares, con lo que, para alcanzar su estado fundamental, deben perder energía. Lo hacen en emisiones electromagnéticas o en emisiones de partículas con una determinada energía cinética. Esto se produce variando la energía de sus electrones (emitiendo rayos X) o de sus nucleones (rayo gamma) o variando el isótopo (al emitir desde el núcleo electrones, positrones, neutrones, protones o partículas más pesadas), y en varios pasos sucesivos, con lo que un isótopo pesado puede terminar convirtiéndose en uno mucho más ligero, como el uranio que, con el transcurrir de los siglos, acaba convirtiéndose en plomo.
La radiactividad se aprovecha para la obtención de energía nuclear, se usa en medicina (radioterapia y radiodiagnóstico) y en aplicaciones industriales (medidas de espesores y densidades, entre otras).
La radiactividad puede ser:
- Natural: manifestada por los isótopos que se encuentran en la naturaleza.
- Artificial o inducida: manifestada por los radioisótopos producidos en transformaciones artificiales.
Radiactividad natural
En 1896 Henri Becquerel descubrió que ciertas sales de uranio emiten radiaciones espontáneamente, al observar que velaban las placas fotográficas envueltas en papel negro. Hizo ensayos con el mineral en caliente, en frío, pulverizado, disuelto en ácidos y la intensidad de la misteriosa radiación era siempre la misma. Por tanto, esta nueva propiedad de la materia, que recibió el nombre de radiactividad, no dependía de la forma física o química en la que se encontraban los átomos del cuerpo radiactivo, sino que era una propiedad que radicaba en el interior mismo del átomo.
El estudio del nuevo fenómeno y su desarrollo posterior se debe casi exclusivamente al matrimonio de Marie y Pierre Curie, quienes encontraron otras sustancias radiactivas: el torio, el polonio y el radio. La intensidad de la radiación emitida era proporcional a la cantidad de uranio presente, por lo que Marie Curie dedujo que la radiactividad es una propiedad atómica. El fenómeno de la radiactividad se origina exclusivamente en el núcleo de los átomos radiactivos. Se cree que se origina debido a la interacción neutrón-protón. Al estudiar la radiación emitida por el radio, se comprobó que era compleja, pues al aplicarle un campo magnético parte de ella se desviaba de su trayectoria y otra parte no.
Pronto se vio que todas estas reacciones provienen del núcleo atómico que describió Ernest Rutherford en 1911, quien también demostró que las radiaciones emitidas por las sales de uranio pueden ionizar el aire y producir la descarga de cuerpos cargados eléctricamente.
Con el uso del neutrón, partícula teorizada en 1920 por Ernest Rutherford, se consiguió describir la radiación beta.
En 1932, James Chadwick descubrió la existencia del neutrón que Rutherford había predicho en 1920, e inmediatamente después Enrico Fermi descubrió que ciertas radiaciones emitidas en fenómenos no muy comunes de desintegración son en realidad neutrones.

Radiactividad artificial
La radiactividad artificial, también llamada radiactividad inducida, se produce cuando se bombardean ciertos núcleos estables con partículas apropiadas. Si la energía de estas partículas tiene un valor adecuado, penetran el núcleo bombardeado y forman un nuevo núcleo que, en caso de ser inestable, se desintegra después radiactivamente. Fue descubierta por la pareja Jean Frédéric Joliot-Curie e Irène Joliot-Curie, bombardeando núcleos de boro y de aluminio con partículas alfa. Observaron que las sustancias bombardeadas emitían radiaciones (neutrones libres) después de retirar el cuerpo radiactivo emisor de las partículas de bombardeo. El plomo es la sustancia que mayor fuerza de impenetracion posee por parte de los rayos x y gamma.
En 1934 Fermi se encontraba en un experimento bombardeando núcleos de uranio con los neutrones recién descubiertos. En 1938, en Alemania, Lise Meitner, Otto Hahn yFritz Strassmann verificaron los experimentos de Fermi. En 1939 demostraron que una parte de los productos que aparecían al llevar a cabo estos experimentos era bario. Muy pronto confirmaron que era resultado de la división de los núcleos de uranio: la primera observación experimental de la fisión. En Francia, Jean Frédéric Joliot-Curie descubrió que, además del bario, se emiten neutrones secundarios en esa reacción, lo que hace factible la reacción en cadena.
También en 1932, Mark Lawrence Elwin Oliphant2 teorizó sobre la fusión de núcleos ligeros (de hidrógeno), y poco después Hans Bethe describió el funcionamiento de las estrellas con base en este mecanismo.
El estudio de la radiactividad permitió un mayor conocimiento de la estructura del núcleo atómico y de las partículas subatómicas. Se abrió la posibilidad de convertir unos elementos en otros. Incluso se hizo realidad el ancestral sueño de los alquimistas de crear oro a partir de otros elementos, como por ejemplo átomos de mercurio, aunque en términos prácticos el proceso de convertir mercurio en oro no resulta rentable debido a que el proceso requiere demasiada energía.
El 15 de marzo de 1994, la Agencia Internacional de la Energía Atómica (AIEA) dio a conocer un nuevo símbolo de advertencia de radiactividad con validez internacional. La imagen fue probada en 11 países.
Clases y componentes de la radiación
Se comprobó que la radiación puede ser de tres clases diferentes, conocidas como partículas, desintegraciones y radiación:
- Partícula alfa: Son flujos de partículas cargadas positivamente compuestas por dos neutrones y dos protones (núcleos de helio). Son desviadas por campos eléctricos y magnéticos. Son poco penetrantes, aunque muy ionizantes. Son muy energéticas. Fueron descubiertas por Rutherford, quien hizo pasar partículas alfa a través de un fino cristal y las atrapó en un tubo de descarga. Este tipo de radiación la emiten núcleos de elementos pesados situados al final de la tabla periódica (A >100). Estos núcleos tienen muchos protones y la repulsión eléctrica es muy fuerte, por lo que tienden a obtener N aproximadamente igual a Z, y para ello se emite una partícula alfa. En el proceso se desprende mucha energía, que se convierte en la energía cinética de la partícula alfa, por lo que estas partículas salen con velocidades muy altas.
- Desintegración beta: Son flujos de electrones (beta negativas) o positrones (beta positivas) resultantes de la desintegración de los neutrones o protones del núcleo cuando éste se encuentra en un estado excitado. Es desviada por campos magnéticos. Es más penetrante, aunque su poder de ionización no es tan elevado como el de las partículas alfa. Por lo tanto, cuando un átomo expulsa una partícula beta, su número atómico aumenta o disminuye una unidad (debido al protón ganado o perdido). Existen tres tipos de radiación beta: la radiación beta-, que consiste en la emisión espontánea de electrones por parte de los núcleos; la radiación beta+, en la que un protón del núcleo se desintegra y da lugar a un neutrón, a un positrón o partícula Beta+ y un neutrino, y por último la captura electrónica que se da en núcleos con exceso de protones, en la cual el núcleo captura un electrón de la corteza electrónica, que se unirá a un protón del núcleo para dar un neutrón.
- Radiación gamma: Se trata de ondas electromagnéticas. Es el tipo más penetrante de radiación. Al ser ondas electromagnéticas de longitud de onda corta, tienen mayor penetración y se necesitan capas muy gruesas de plomo u hormigón para detenerlas. En este tipo de radiación el núcleo no pierde su identidad, sino que se desprende de la energía que le sobra para pasar a otro estado de energía más baja emitiendo los rayos gamma, o sea fotones muy energéticos. Este tipo de emisión acompaña a las radiaciones alfa y beta. Por ser tan penetrante y tan energética, éste es el tipo más peligroso de radiación.
Las leyes de desintegración radiactiva, descritas por Frederick Soddy y Kasimir Fajans, son:
- Cuando un átomo radiactivo emite una partícula alfa, la masa del átomo (A) resultante disminuye en 4 unidades y el número atómico (Z) en 2.
- Cuando un átomo radiactivo emite una partícula beta, el número atómico (Z) aumenta o disminuye en una unidad y la masa atómica (A) se mantiene constante.
- Cuando un núcleo excitado emite radiación gamma, no varía ni su masa ni su número atómico: sólo pierde una cantidad de energía hν (donde "h" es laconstante de Planck y "ν" es la frecuencia de la radiación emitida).
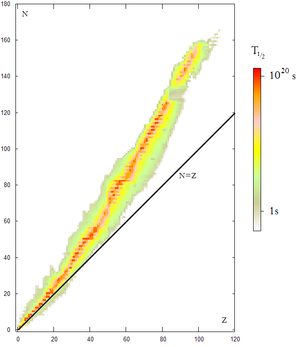
Las dos primeras leyes indican que, cuando un átomo emite una radiación alfa o beta, se transforma en otro átomo de un elemento diferente. Este nuevo elemento puede ser radiactivo y transformarse en otro, y así sucesivamente, con lo que se generan las llamadas series radiactivas.
Causa de la radiactividad
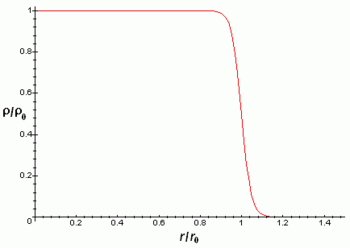
En general son radiactivas las sustancias que no presentan un balance correcto entre protones o neutrones, tal como muestra el gráfico que encabeza este artículo. Cuando el número de neutrones es excesivo o demasiado pequeño respecto al número de protones, se hace más difícil que la fuerza nuclear fuerte debido al efecto del intercambio de piones pueda mantenerlos unidos. Eventualmente, el desequilibrio se corrige mediante la liberación del exceso de neutrones o protones, en forma de partículas α que son realmente núcleos de helio, y partículas β, que pueden ser electrones o positrones. Estas emisiones llevan a dos tipos de radiactividad, ya mencionados:
- Radiación α, que aligera los núcleos atómicos en 4 unidades másicas, y cambia el número atómico en dos unidades.
- Radiación β, que no cambia la masa del núcleo, ya que implica la conversión de un protón en un neutrón o viceversa, y cambia el número atómico en una sola unidad (positiva o negativa, según si la partícula emitida es un electrón o un positrón).
La radiación γ, por su parte, se debe a que el núcleo pasa de un estado excitado de mayor energía a otro de menor energía, que puede seguir siendo inestable y dar lugar a la emisión de más radiación de tipo α, β o γ. La radiación γ es, por tanto, un tipo de radiación electromagnética muy penetrante, ya que tiene una alta energía por fotón emitido.
Período de semidesintegración radiactiva
La desintegración radiactiva se comporta en función de la ley de decaimiento exponencial:
donde:
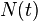 es el número de radionúclidos existentes en un instante de tiempo
es el número de radionúclidos existentes en un instante de tiempo 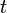 .
. es el número de radionúclidos existentes en el instante inicial
es el número de radionúclidos existentes en el instante inicial  .
.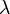 , llamada constante de desintegración radiactiva, es la probabilidad de desintegración por unidad de tiempo. A partir de la definición de actividad (ver Velocidad de desintegración), es evidente que la constante de desintegración es el cociente entre el número de desintegraciones por segundo y el número de átomos radiactivos (
, llamada constante de desintegración radiactiva, es la probabilidad de desintegración por unidad de tiempo. A partir de la definición de actividad (ver Velocidad de desintegración), es evidente que la constante de desintegración es el cociente entre el número de desintegraciones por segundo y el número de átomos radiactivos (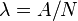 ).
).
Se llama tiempo de vida o tiempo de vida media de un radioisótopo el tiempo promedio de vida de un átomo radiactivo antes de desintegrarse. Es igual a la inversa de la constante de desintegración radiactiva (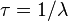 ).
).
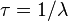 ).
).
Al tiempo que transcurre hasta que la cantidad de núcleos radiactivos de un isótopo radiactivo se reduzca a la mitad de la cantidad inicial se le conoce como periodo de semidesintegración, período, semiperiodo, semivida o vida media (no confundir con el ya mencionado tiempo de vida) (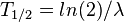 ). Al final de cada período, la radiactividad se reduce a la mitad de la radiactividad inicial. Cada radioisótopo tiene un semiperiodo característico, en general diferente del de otros isótopos.
). Al final de cada período, la radiactividad se reduce a la mitad de la radiactividad inicial. Cada radioisótopo tiene un semiperiodo característico, en general diferente del de otros isótopos.
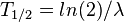 ). Al final de cada período, la radiactividad se reduce a la mitad de la radiactividad inicial. Cada radioisótopo tiene un semiperiodo característico, en general diferente del de otros isótopos.
). Al final de cada período, la radiactividad se reduce a la mitad de la radiactividad inicial. Cada radioisótopo tiene un semiperiodo característico, en general diferente del de otros isótopos.





 y luego decae rápidamente hasta prácticamente 0 en una distancia
y luego decae rápidamente hasta prácticamente 0 en una distancia  de acuerdo con la fórmula:
de acuerdo con la fórmula:
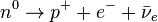
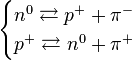


 , siendo
, siendo  la
la  , es la carga eléctrica del centro dispersor.
, es la carga eléctrica del centro dispersor. , es la energía cinética inicial de la partícula alfa incidente.
, es la energía cinética inicial de la partícula alfa incidente. es el parámetro de impacto.
es el parámetro de impacto.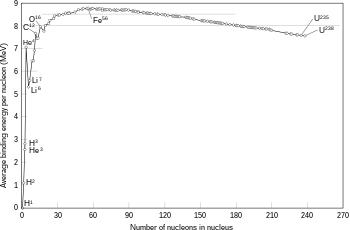
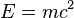 de Einstein, por la cual parte de la masa está en forma de energía de ligazón entre dichos componentes. Cuantiativamente se tiene la siguiente ecuación:
de Einstein, por la cual parte de la masa está en forma de energía de ligazón entre dichos componentes. Cuantiativamente se tiene la siguiente ecuación:
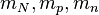 son respectivamente la masa del núcleo, la masa de un protón y la masa de un neutrón.
son respectivamente la masa del núcleo, la masa de un protón y la masa de un neutrón.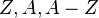 son respectivamente el
son respectivamente el  es la energía de enlace entre todos los nucleones.
es la energía de enlace entre todos los nucleones.